Dr. Alexander Flemings opdagelse af
penicillin i 1928 muliggjorde behandlingen af ellers livstruende
bakterieinfektioner. Siden da er utallige nye antibiotika blevet
identificeret, hvilket har betydet at vi i den vestlige verden i dag
tager det for givet at bakterielle infektionssygdomme let kan kureres.
Denne sikkerhed er dog truet af årtiers
meget omfattende brug af antibiotika til ikke-medicinske formål, såsom
vækstfremmer i dyrehold og akvakulturer, kombineret med forkert
administration af antibiotika under behandling af mennesker. Dette har
medført udvikling og spredning af antibiotikaresistens blandt
sygdomsforårsagende bakterier.
Ved antibiotikaresistens forstås
bakteriers evne til at modstå de skadelige effekter et antibiotikum
normalt påfører ikke-resistente bakterier.
Der findes som nævnt mange forskellige
antibiotika og disse er giftige for bakterier på forskellige måder,
derfor vil antibiotika resistens mod en type antibiotika ikke beskytte
bakterien mod alle former for antibiotika. Antibiotika kan inddeles i
forskellige grupper på basis af deres virkemåde, altså hvilke biologiske
processer de ødelægger i de bakterier de rammer. Hvis to forskellige
antibiotika har samme virkemåde forøges sandsynligheden for at udvikling
af resistens mod det ene stof også vil gøre bakterien resistent over for
det andet stof (kendt som krydsresistens).
Udvikling af antibiotikaresistens
Bakteriers udvikling af antibiotikaresistens er en naturlig proces der altid har fundet sted. I naturen
finders der nemlig mange forskellige mikroorganismer der danner
antibiotiske stoffer med det formål at bekæmpe konkurrenter, og derved
få en fordel i kampen om ressourcer. Det betyder at bakterier der
allerede har resistens, eller som udvikler modstandsdygtighed overfor
antibiotika vil klare sig bedre i konkurrence med andre mikroorganismer.
Udviklingen af antibiotikaresistens
følger de gængse spilleregler for evolution, hvor nøglebegrebet er
”overlevelse af de(n) bedst egnede”. Evolutionsprocessen består
essentielt set af to hovedfaktorer: Diversitet og
Selektionstryk. Ved diversitet forstås forskelligheden i hvilke
egenskaber individerne i en population har, fx antibiotika resistens vs.
sensitivitet. Mens selektionstryk betyder de faktorer, typisk ydre, der
har betydning for hvordan de forskellige individer i en population
klarer sig, fx om der er antibiotika i det miljø populationen lever i.
Normalt spiller sex en meget vigtig rolle
for en arts evne til at tilpasse sig ændringer i miljøet. Årsagen er at
sex giver mulighed for let at skabe nye kombinationer af gener (eller
mere nøjagtigt nye versioner af gener kaldet alleler), ved at blande to
forskellige genomer (halvdelen fra faderen og halvdelen fra moderen)
hvorved der opstår en ny kombination af gener. Denne nye kombination som
afkommet har, er forskellig fra den begge forældrene har.
Bakterier har ikke sex og de må
formere sig
ved at lave en så nøjagtig kopi af sig selv som muligt. Under
kopieringsprocessen sniger der sig en gang imellem små fejl ind, kaldet
mutationer. Da bakterier typisk har en kort generationstid og en høj
mutationsrate, sammenlignet med andre organismer, kan de hurtigt ophobe
mutationer. Dette kan være en fordel, da mutationer er selve råstoffet
for udvikling/evolution - for uden forskellighed er der jo ingen der kan
klare sig bedre end andre, hvis miljøet ændrer sig.
Mutationer kan have en negativ,
neutral eller positiv effekt for bakteriens evne til at overleve og
konkurrere med andre bakterier, både fra andre arter og indenfor samme art.
Mutationer med en negativ effekt vil betyde at bakterien vil klare sig
dårligere i forhold til andre bakterier, hvorfor den vil forblive
sjælden og højst sandsynlig uddø med tiden. Positive mutationer vil
derimod betyde at bakterien vil klare sig bedre end sin konkurrenter, og dermed
overleve og få flere
efterkommere. Neutrale mutationer har umiddelbart ingen effekt på
hvordan bakterien klarer sig, men det er vigtigt at huske at effekten af
en mutation kan være forskellig fra miljø til miljø. Så en neutral
mutation kan blive positiv, negativ eller forblive neutral hvis miljøet
ændrer sig. Der er eksempelvis ikke nogen umiddelbar fordel ved at kunne
beskytte sig mod et antibiotikum hvis man ikke udsættes for det. På den
anden side kan det være godt at have denne egenskab, hvis der pludselig
dukker en konkurrent op der kan producere det pågældende antibiotikum.
For at en mutation skal blive succesfuld
(få stor udbredelse) skal der findes et selektionstryk der favoritiserer
individer der har mutationen. Hvis vi forestiller os en population af
bakterier hvor nogle få individer har en mutation der gør dem resistente
overfor et antibiotika, men som også betyder at de deler sig lidt
langsommere end de øvrige i population. Hvis population ikke udsættes for
antibiotikaet vil individerne med resistensen blive udkonkurreret og
forsvinde. Men hvis populationen udsættes for store mængder af
antibiotikaet vil alle de sensitive bakterier dø (eller klare sig
dårligere), mens de resistente bakterier vil overleve, da de er bedre
tilpasset det nye miljø. I tilfældet med antibiotikaresistens er det
let at få øje på fordelen, mens det i andre tilfælde kan være meget
svært at indse hvilke fordele en given egenskab giver bæreren i forhold
til andre individer i en population. Og nogle gange er forklaringen at
egenskaben ikke giver en fordel, men at den optræder sammen med (er
koblet til) en anden egenskab der giver en fordel (se senere).
Overførsel af antibiotikaresistens
I forbindelse med antibiotikaresistens
er det vigtigt at skelne mellem to basalt forskellige typer af resistens:
1) ændring af den biologiske proces antibiotikummet virker på og 2) pro-aktiv
resistens hvor bakterien opnår evnen til at inaktivere antibiotikummet.
De fleste antibiotika virker ved at binde til/reagere med bestemte
proteiner/molekyler i bakterien, for derved at inaktivere dem eller
ændre deres aktivitet så de ikke virker normalt. I type 1 resistens sker
der en ændring i bakterie proteinet så antibiotikummet ikke længe kan
påvirke det, hvilket betyder at bakterien bliver resistent. I pro-aktiv
resistens (type 2) opnår bakterien evnen til at ændre på
antibiotikummet eller pumpe det ud af bakterien, så det ikke længere kan påvirke
bakterien negativt. Type 1 resistens skyldes oftest mutationer i dele af
cellens centrale apparatur, mens type 2 resistens skyldes ændringer i
eksisterende beskyttelses systemer. Generne der muteres (ændres) i type
1 resistens findes typisk på bakteriens kromosom og er essentiel for
cellens overlevelse, mens generne der er involveret i type 2 resistens
typisk findes på små cirkulærer DNA stykker, kaldet plasmider.
Når en mutation med en positiv effekt,
eks. antibiotikaresistens, er opstået i en bakteriecelle kan den nogle
gange overføres til en anden bakteriecelle. Dette sker via en proces der
kaldet konjugation. Ved konjugation danner to bakterieceller en direkte
forbindelse mellem sig og kan derved overføre arvemateriale (DNA). Dette
kræver dog i de fleste tilfælde at genet der koder for den positive
egenskab findes på et plasmid. Konjugation er et godt alternativ til sex, da det tillader en bakterie at dele sin nyvundne egenskab med andre
individer i populationen og ikke kun med sine efterkommere, som det er
tilfældet ved sex.
Multiresistens
Når en bakterie er resistent overfor
mange forskellig typer af antibiotika kaldes den for multiresistent,
også kendt som multi-drug-resistance (MDR). Denne situation kan
eksempelvis opstå hvis flere antibiotika resistens gener havner på samme
plasmid, hvorved resistens generne bliver koblede (rent arvemæssigt).
Koblingen betyder at de resistens gener på plasmidet der ikke giver en
umiddelbar fordel i det miljø bakterien lever, vil blive bevaret så
længe et af de andre resistens gener på plasmidet giver en fordel. Andre
typer af resistens, såsom tungmetalresistens kan forekomme på samme
plasmider som antibiotika resistens. En situation der betyder at der kan
opstå ”super” resistens plasmider, der kan beskytte bakterien mod alle
mulige forskellige farer.
Da vi kun har et begrænset antal
antibiotika der kan bruges til behandling af infektionssygdomme i
mennesker, dels pga bivirkninger og krydsresistens, udgør
multiresistente bakterier et stort problem. Populært sagt så er vi ved
at løbe tør for antibiotika til behandling af infektioner, da nogle
bakterier er resistente over for stor set alle anvendte antibiotika.
Hvordan havner flere resistens gener på
samme plasmid? Det er vigtigt at huske at arvemassen (DNA’et) ikke er
uforanderligt og at gener nogle gang bytter plads eller flyttes mellem
bakteriens kromosom og evt plasmider der findes i cellen. Hvilket gør
det muligt at flere resistens gener kan havne på samme plasmid.
Hvorfor har vi nu pludselig problemer med
at behandle bakterieinfektioner?
De sidste mange års liberale brug af
antibiotika som vækstfremmer i landbruget har betydet at bakterier har
været udsat for et konstant antibiotikum selektionspres, hvilket har
fremmet udviklingen og spredningen af antibiotikaresistens gener – da
der har været en fordel ved at være resistent.
Begrebet vækstfremmer dækker over
rutinemæssig tilsætning af forskellige stoffer til produktiondyrs foder
for at øge deres tilvækst og sænke foderforbruget og den tid det tager
for at opnå slagtevægt. Antibiotika kan bruges som meget effektive
vækstfremmere, og virker blandt andet ved at forebygge smitsomme sygdomme
i husdyr besætninger. I Danmark er det ikke længere tilladt at bruge
antibiotika til dette formål, men stofferne bruges forsat mange steder i
verden. I stedet for antibiotika bruger man i dag probiotiske
mikroorganismer eller enzymer der hjælper produktionsdyrerne med at
nedbryde foderet bedre hvorved det udnyttes bedre. Der bruges dog
stadigt store mænger antibiotiske stoffer til behandling af syge dyr og
i mange tilfælde behandles hele dyrebesætninger, selv om kun få dyr er
syge, med det formål at forhindre at raske dyr smittes.
Det er sjældent at bakterier der
forårsager sygdomme i produktionsdyr også kan gøre mennesker syge,
hvorfor man skulle tro at landbrugets brug af antibiotika som
vækstfremmer ikke skulle have den store betydning for vores evner til at
behandle bakterielle infektioner i mennesker. Bakteriers evne til at
overføre resistens gener via konjugation betydet dog at antibiotika
resistens der er opstået i ikke human patogene bakterier kan overføres
til human patogene bakterier.
Landbruget bærer ikke hele skylden for
vores nuværende problemer med antibiotikaresistente bakterier i
sundhedsvæsenet. Også inden for sundhedssystemet er antibiotiske stoffer
ikke altid blevet brugt fornuftigt. Nogle gange bruges der for lav dosis
eller behandlingen afbrydes for tidligt, enten fordi patienten føler sig
rask eller ikke har råd til at forsætte behandlingen, hvilket specielt
er et problem i tredje verdens lande.
Både for lav dosis og afkortet behandling
øger sandsynligheden for at resistens opstår. Dette skyldes dels at fuld
resistens sjældent opstår med en enkelt mutation, men udvikles gradvis
gennem ophobning af flere gavnlige mutationer. Delvist resistente
bakterier vil kunne overleve lave antibiotika koncentrationer, mens de
ikke resistent bakterier i populationen vil dø eller bliver hæmmet. En
situation der giver de delvist resistente bakterier en fordel, hvorfor
de vil blive dominerende i populationen. I starten af behandlingen vil
patienten få det bedre da antallet af bakterier falder, men efter noget
tid vil antallet af de delvist resistente bakterier være så stor at
sygdommen igen vil tage til i styrke. Den lave dosis fremmer altså
forekomsten af delvis resistente bakterier og øger sandsynligheden for
at fuld antibiotika resistens opnås.
Da man først indså problemet med
antibiotika resistens og multiresistens forsøgte man på globalt plan at
reservere en række antibiotika. Meningen var at disse antibiotika kun
skulle bruges som sidste udvej til behandling af patienter der var
inficeret med multiresistente bakterier. Håbet var at man ved at
begrænse deres brug kunne forhindre udviklingen af resistens, ved at
sikre at bakterierne ikke blev udsat for stofferne og dermed ikke fik
mulighed for at udvikle resistens.
Det nok bedst kendte eksempel på
udvikling af multiresistens hos en human patogen bakterie er Staphylococcus aureus (også kaldet gule stafylokokker),
der blandt andet forårsager alvorlige infektioner i operationssår. S. aureus
blev først resistent overfor penicillin, så methycillin og senest
vancomycin. Vancomycin var ellers et af de stoffer man havde reservert
til behandling af multi-resistente bakterier, men i 2002 blev de første
tilfælde af vancomycin resistente S. aureus rapporteret. Man har siden
udviklet en række antibiotika der kan bruges til behandling af S. aureus
infektioner, så som linezolid, dalfopristin/quinupristin og daptomycin.
Forsøg på at løse problemet med
multiresistente bakterier:
Udviklingen af antibiotika med nye
virkemåder er en dyr affære, og de fleste private farmaceutiske firmaer
har valgt ikke at satse på dette område, da det vil være svært at tjene
de investerede penge ind igen. I starten af 2000’erne erkendte nationale
og internationale institutioner at der var et behov for en offentlig
indsats på dette område. Disse initiativer resulterede i en række
handlingsplaner og anbefalinger, såsom at forbruget af antibiotika
generelt skulle reduceres, at der skulle udvikles bedre patient
behandlingsplaner og metoder til at bremse smitten fra syge til raske
mennesker. I EU forbød man brugen af en række vækstfremmere, og indførte
strengere regler for hvornår antibiotika må udskrives til mennesker og
dyr. Dette har betydet at det totale antibiotika forbrug er faldet og at
problemerne med multiresistens er blevet begrænset.
Dette er dog ikke tilfældet i
udviklingslande, hvor begrænsede økonomiske midler og problemer med
selvmedicinering, betyder at disse lande nu udgør hot-spots for
udvikling af nye typer af resistens og multiresistens. Globaliseringen
og vores øgede rejselyst betyder at de vestlige lande med tiden vil arve
disse problemer.
Denne menneskeskabte resistens samt det
naturlige evolutionære drive der findes for at udvikle resistens betyder
at der er et behov for at identificere og/eller udvikle antibiotika med
nye virkemåder. Og så skal vi sikre at disse nye stoffer ikke misbruges.
(Tilbage til toppen)
Langt de fleste proteiner/enzymer der
findes i naturen udfører en bestemt funktion, såsom at pumpe et stof
over en membran, binde flere proteiner sammen eller at fremme (katalysere)
en kemisk reaktion. Evnen til at katalysere en kemisk reaktion er typisk
koblet til en meget lille del af enzymet, kaldet det aktive sted
(active site på engelsk). Funktionen af det aktive sted er at
positionere substraterne (de stoffer der skal reagere med hinanden)
rigtigt i forhold til hinanden og i forhold til de nøgle-aminosyrer i
enzymet der katalyserer reaktionen. Ofte katalyseres selve reaktionen
kun af 2-3 aminosyrer i det aktive sted, mens funktionen for resten af
aminosyrerne i enzymet (typisk flere hundrede) er rent strukturelt.
I naturen findes der også enzymer der kan
udføre flere forskellige opgaver, disse kaldes multizymer (multi
= mange, zymer = enzymer). Multizymer indeholder mange aktive steder,
der hver især kan katalysere én kemisk reaktion. Et eksempel på dette er
de enzymer der er ansvarlige for at danne polyketider (poly = mange,
ketid = -CH2-CO-
enhed), disse enzymer kaldes polyketid syntaser (synt = syntese,
dannende, -ase = enzym).
Polyketider
er små kemiske forbindelser der er opbygget af ketid enheder -CH2-CO-
(se figuren herunder). Disse stoffer dannes af bakterier, planter og
svampe, men ikke dyr. Specielt skimmelsvampe danner mange forskellige
polyketider. Mange af disse stoffer er biologisk aktive og de organismer
der danner dem, bruger dem til at påvirke andre organismer i det miljø
de lever i. Bioaktiviteten kan enten bestå i at stofferne hæmmer
eller dræber andre organismer (toksiner og antibiotika) eller de kan
virke som signal molekyler der giver mulighed for at individer af samme
art kan kommunikere.
FIGUR MED POLYKETID STRUKTUR
Der findes flere forskellige typer af
polyketid syntaser og de inddeles typisk i tre hovedgrupper (I, II og
III) på baggrund af hvordan de er opbygget og måden de syntetiser
polyketider. Type I polyketid syntaser er multizymer, mens type II og
III består af protein komplekser (flere enzymer der går sammen) og de
vil ikke blive beskrevet her.
Type I polyketid syntaser kan opdeles
yderligere i to grupper, der henholdsvis kaldes "modulære" og
"iterative" Type I polyketide syntaser (Modulær = opbygget af moduler,
Iterativ = gentagende). Alle type I polyketid syntaserne kan katalysere
følgende kemiske reaktion, hvor produktet er bundet til enzymet (E):
Reaktion 1:
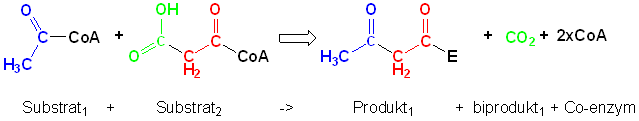
Dette kræver tre aktive steder: Keto-syntase
(KS), Acyl-transferase (AT) og Acyl-Carrier-Protein (ACP).
Acyl-transferase delen står for at loade substrater (acetyl og malonyl)
ind i enzymet, Acyl-Carrier-Protein delen indeholder en fleksibel arm
der kan flytte substrater og de resulterende produkter rundt mellem de
andre aktive steder i enzymet, mens Keto-syntase delen katalyser selve
reaktionen (reaktion 1).
I det følgende findes først en
beskrivelse af modulære polyketid syntaser og efterfølgende iterative
polyketid syntaser. Jeg har valgt at inkludere en gennemgang af de
modulære enzymer, selv om de ikke findes i svampe, fordi de er de bedst
karakteriserede polyketid syntaser og det meste af den viden vi har om
iterative enzymer er overført fra de modulære. Desuden er de modulære
enzymer umiddelbart lidt lettere at forstå end de iterative.
Modulære Type I polyketid syntaser:
Modulær Type I polyketid syntaser
indeholder flere KS-AT-ACP moduler der er placeret efter hinanden:
Modul 1
Modul
2 Modul 3
Denne opbygning tillader enzymet at
udføre koblede reaktioner, hvor produktet fra modul 1 gives videre til
modul 2 hvor det virker som substrat for en ny reaktion. Produktet fra
modul 2 kan så igen gives videre til modul 3, hvor det så kan bruges som
substrat og så videre.
Denne opbygning resulterer i lange kæder
opbygget af -CH2-CO-
enheder (den første enhed er dog en CH3-CO-
enhed).
De beskrevne reaktioner, hvor små enheder
bestående af to kulstofatomer sættes sammen til lange kulstofkæder,
kaldes for en polymerisering. Polymerisering af simple molekyler til
store komplekse molekyler kendes fra mange andre typer af biologiske
molekyler, såsom proteiner (hvor de tyve forskellige aminosyrer sættes
sammen) eller DNA (hvor de fire forskellige nukleinsyrer sættes sammen
til lange kæder). I disse to tilfælde stammer diversiteten i de
resulterende molekyler (protein og DNA) fra hvilke enheder de er
opbygget af og rækkefølgen de enkelte enheder sidder i.
Dette er også tilfældet for polyketider, hvor forskellige typer af substrater kan samles og derved påvirkes
hvordan det endelige polyketid molekyle kommer til at se ud.
Der findes dog andre og vigtigere kilder
til kemisk diversitet i polyketider: Fx 1) keton-grupperne (=O) der
findes på hvert andet kulstofatom kan modificeres, 2) længden af
polyketidet kan variere, 3) påsættelse af -CH3
eller -CH2CH3
grupper på de forskellige kulstofatomer. 4) Keton grupperne kan
reduceres i forskellige grader, hvilket afhænger af tre "nye" aktive
steder: keto-reduktase (KR), dehydratase (DH) og enoyl-reduktase (ER),
der katalyser følgende reaktioner.
De tre aktive steder der modificer keton-grupperne
virker altid i samme rækkefølge (KR->DH->ER), men det er ikke altid at
alle tre findes i samme modul. Dette betyder at ketid-enheder i samme
polyketid kan se meget forskelligt ud:
For modulære
polyketid syntaser er det muligt at forudsige en række egenskaber ved
produktet, ved at analysere rækkefølgen af de forskellige aktive steder
der findes i enzymet. Længden af polyketidet kan for eksempelvis
forudsiges ved at tælle antallet af moduler eller mere præcist antallet
af AT domæner.
Da modulerne i en modulær polyketid
syntase altid virker i samme rækkefølge (fra starten af enzymet kaldet
N-terminalen til slutningen af enzymet kaldet den C-terminal ende) og
kun bruges en gang, kan man også forudsige hvordan de enkelte ketid
enheder i det endelige produkt vil se ud, ved at kigge på hvilke aktive
steder der findes i de enkelte moduler.
Figuren
herunder viser hvordan den voksende polyketid-kæde bevæger
sig fra
modul til modul. Kæden er bundet til enzymet via en thioester
binding
til ACP domænets fleksible arm. Det er det samme enzym der
er vist
tre gange, men i forskellige stadier af syntesen.
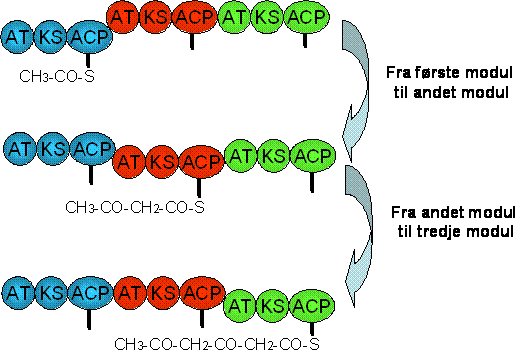
Udover de centrale moduler indeholder
modulære polyketid syntaser også et loading modul (LD) og et frigivelses
modul (thioesterase = TE). Loading modulet er ansvarlig for at den
første enhed af polyketid-kæden, kaldet starter-enheden, kommer ind i
enzymet. Mens frigivelses modulet er ansvarlig for at frigive det
færdige produkt fra enzymet.
På baggrund af dette ville en modulær
polyketid syntase med følgende opbygning:

Give følgende produkt:
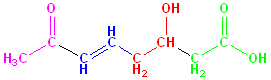
(bemærk at KR og DH virker på den keton-gruppe der er inkorporeret af
det foregående modul)
Iterative polyketid syntaser
Iterative polyketid syntaser kan
essentielt set det samme som beskrevet ovenfor for de modulære polyketid
syntaser - de adskiller sig dog ved kun at bestå af et enkelt modul! De
aktive steder i dette enkelte modul kan til gengæld genbruges flere
gange under syntesen af et produkt. Den voksende polyketid-kæde
præsenteres af ACP domænets fleksible arm for de forskellige aktive
steder i en forudbestemt rækkefølge. Hver gang den voksende
polyketid-kæde bliver præsenteret for keto-syntase domænet vil det få
påsat en ny ketid-enhed og dermed vokse i længden med to kulstofatomer.
Hver runde hvor de forskellige aktive steder virker kaldes for en
iteration (gentagelse), hvilket har givet navn til denne enzym gruppe.

Sammenligning af hvordan produktet bevæger sig i henholdsvis en modulær
og iterativ polyketid syntase (kun de mest essentielle aktive steder er
vist i figuren). Det enkelte strukturelle modul der findes i iterative
enzymer kan opføre sig forskelligt fra iteration til iteration hvorfor
et kan betragtes som flere funktionelle moduler.
Dette betyder at der for disse enzymer
ikke er en sammenhæng mellem antallet af moduler/aktive steder og
længden på det færdige produkt.
Ligesom de modulære enzymer kan iterative
polyketid syntaser også indeholde modificerende aktive steder. Det lidt
specielle er at disse ikke nødvendigvis bruges i hver iteration enzymet
gennemfører. Så produkterne af disse enzymer kan lige som produkterne af
de modulære polyketid syntaser også indeholde ketid-enheder med
forskellige modificeringer af keton-grupperne. På basis af dette kan det
enkelte strukturelle modul som iterative enzymer består af betragtes som
flere funktionelle moduler der kan opfører sig forskelligt fra iteration
til iteration.
På nuværende tidspunkt er det ikke
muligt, på basis af en iterativ polyketid syntases opbygning, at
forudsige produktets længde eller hvilke modifikationer de enkelte
ketid-enheder i produktet vil have. I øjeblikket arbejder flere
internationale forskergrupper dog på at løse dette problem. De
foreløbige resultater tyder på at man måske kan forudsige længden af
produkterne ved at analysere hvor meget plads der er i det aktive site
af de forskellige enzymer.
De iterative polyketid syntaser kan
opdeles i flere undergrupper på basis af hvilke modificerende aktive
steder de indeholder og dermed hvordan deres produkter ser ud:
Ikke-reducerende:
SAT-KS-AT-PT-ACP-TE
Reducerende:
KS-AT-KR-(DH)-(ER)-ACP-TE
Reducerende iterative polyketid syntaser
Produkterne af disse enzymer er typisk
lineære molekyler hvor keton grupperne er blevet reduceret i forskellige
grader.
Ikke-reducerende iterative polyketid
syntaser
Produkterne fra disse enzymer indeholder
keton-grupper på hvert andet kulstof-atom. Da disse grupper let reager
med andre atomer, sker der typisk reaktioner mellem keton grupper og
kulstofkæden hvilket resulter i dannelsen af små ring-strukturer, kaldet
aromatiske ringe. Disse polyaromatiske stoffer er typisk stærk farvede
og virker som pigmenter.
Denne
gruppe af polyketid syntaser indenholder nogle specielle aktive steder
der ikke findes i de andre typer af enzymer. SAT (starter unit
acyl-transferase) er ansvarlig for at loade første ketid-enhed og PT
(produkt form) dikterer hvordan polyketid-kæden folder sig og dermed
hvilke keton-grupper der reager med kulstof-atomerne i polyketid-kæden.
(Tilbage
til toppen)
Ideen med CIPS projektet er at danne nye
stoffer ved at kombinere aktive steder fra naturlige polyketid syntaser
på nye måder. Ideen udspringer fra den erkendelse at naturlige enzymer
med samme kombination af aktive steder godt kan producere vidt
forskellige stoffer. Nedenfor vises et par eksempel på dette.

Polyketid
syntaserne fra filamentøse svampe, der er ansvarlige for dannelsen af en
række pigmenter og mykotoksiner. Enzymerne har samme aktive steder men
deres produkter varierer både mht. længde, foldningsmønster af
polyketidkæden og hvilke substrater der kondenseres.
Kimærisk betyder sammensat eller
sammenbragt. De aktive steder i iterative polyketid syntaser kan
sammenlignes med farvede klodser der hver har en egenskab. Ved at samle
klodser fra mange forskellige naturlige enzymer og efterfølgende sætte
dem sammen på nye måder vil man få nye enzymer. Ideen er at samle disse
klodser på en tilfældig måde og derved få dannet en masse forskellige
kombinationer af klodser (egenskaber). Af de nye enzymer vil en del være
funktionelle og kunne danne nye stoffer.
Samlingen af dissee nye enzymer vil ske i
bagegær (Saccharomyces cerevisiae) da de er lettere at arbejde med i
laboratoriet og ikke selv producerer antibiotiske stoffer. Hver
samlingsproces (kaldet en kloning) vil resultere i en masse gærstammer,
der hver især indeholder en ny kimærisk polyketid syntase. De enkelte
gærstammer vil derefter blive undersøgt for om de danner bioaktive
stoffer der kan hæmme forskellige bakteriearters vækst.
(Tilbage
til toppen)

